
题目列表(包括答案和解析)
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为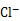 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为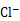 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为
。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com