(14分)
含硫化合物在工业生产中有广泛的用途。
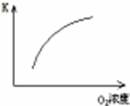
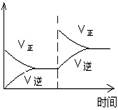
(1)对于可逆反应2SO2(g)+O2(g)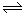 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
序号
| A
| B
| C
| D
|
目的
| 压强对平衡的影响
| 温度对转化率的影响
| 增加O2浓度对速率的影响
| 浓度对平衡常数的影响
|
图示
| 
| 
| 
| 
|
(2)在500
0C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO
2和1molO
2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO
3的体积分数甲
乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO
2、1molO
2,测得SO
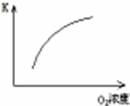
2的平衡转化率与温度的关系如下图所示。
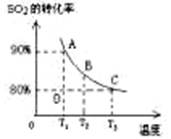
Ⅰ.在T
1温度下,反应进行到状态D时,v
正 v
逆。(填“>”“<”或“="”" )
Ⅱ.T
3温度下,平衡时测得反应放出的热量为Q
1,在相同温度下若再向容器中通入2molSO
2、1molO
2,重新达到平衡,测得反应又放出热量Q
2 。则下列说法中正确的是
。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q
2一定大于Q
1C.新平衡时SO
2的转化率一定大于80%
(4)在甲容器中充入一定量的SO
2和1.100molO
2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO
2的转化率为
。
(5)若用氢氧化钠溶液吸收SO
2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为
。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO
2气体,若得到pH=5的H
2SO
3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为
。(已知该温度下H
2SO
3的电离常数:K
a1=1.0×10
-2mol/L,K
a2=6.0×10
-3mol/L)

 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是 




 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是