
题目列表(包括答案和解析)
Ⅰ.大多数的化学反应都是可逆反应。
在一个容积为2.0L的固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) ![]() 3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
(1)用B的浓度变化来表示的反应速率u(B)=____。该反应在此条件下的化学平衡常数K=____(结果用分数表示)。
(2)在相同实验条件下,若在同一容器中加入2.0molA和8.0molB,若要求平衡后C在反应混合气中体积分数不变,则还应加入C ____mol。
(3)在相同实验条件下,若在同一容器中加入3.0molA和一定量的B,平衡时C的物质的量为3.0mol,则加入的B的物质的量为____mol
Ⅱ.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合,所得溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是( )
A.c(HA)<c(A―) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A―) D.c(OH―)=c(H+)+![]() [c(HA)一c(A―)]
[c(HA)一c(A―)]
(2)常温下,在20mL0.1mol/L![]() 溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(
溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(![]() 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
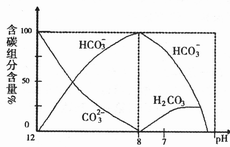
回答下列问题:
①在同一溶液中,![]() ,、
,、![]() 、
、![]() (填:“能”或“不能”)____大量共存。
(填:“能”或“不能”)____大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:____
③已知在![]() 时,
时,![]() 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数
![]() ,当溶液中c(
,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液的pH:___。
)=2:1时,溶液的pH:___。
在温度为830K时,可逆反应CO(g)+H2O(g)![]() H2(g)+CO2(g)达平衡且具有某些特殊性.若起始浓度CO为2 mol/L,H2O为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度增大到6 mol/L,则CO的转化率为75%.
H2(g)+CO2(g)达平衡且具有某些特殊性.若起始浓度CO为2 mol/L,H2O为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度增大到6 mol/L,则CO的转化率为75%.
设830K时,起始浓度CO为a mol/L,H2O为b mol/L,反应达到平衡时H2为c mol/L,请根据上述有关数据之间的关系,总结出具体的规律,填写以下空白:
(1)b不变,a减小,重新达到平衡时,CO的转化率H2O的转化率________(均填“升高”、“降低”或“下变”)
(2)当a=5,c=![]() 时,b=________
时,b=________
(3)当a=b时,![]() =________
=________
(4)用来表示a、b、c之间关系的代数式是________.
 2SO3(l),2min后测得O2的物质的量为1.6mol,则:
2SO3(l),2min后测得O2的物质的量为1.6mol,则:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com