
题目列表(包括答案和解析)
(8分)已知A、B、C三种元素均为第二周期非金属元素,其原子序数依次增大,且它们之间可以形成分子式为AC、BC、AC2和BC2的四种常见化合物。A、B、C可分别与氢原子形成电子总数相等的分子。
请回答下列问题:
(1)写出A、B、C三种元素的元素符号:A________,B________,C________。
(2)AC2的电子式为____________________________________________________。
(3)氢原子可以与A、B、C分别形成两组电子总数相等的分子,其电子总数分别为________和________。
(4)由1个A原子、2个B原子、1个C原子与4个氢原子构成的分子中,每个原子最外层均达到稳定结构,该分子的结构简式为________。
(8分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如图所示的转化关系。
(1)如果A、B、C、D均是10电子的微粒,请写出:A的结构式________,D的电子式________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出:
①A与B在溶液中反应的离子方程式___________________________________
________________________________________________________________________。
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
(3)已知肼(H2N—NH2)和甲胺(CH3—NH2)都是18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________________________________________________________________________
________________________________________________________________________。
(8分)已知:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
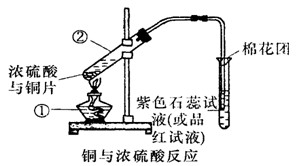
(1)写出标号①的仪器的名称: 。
(2)将产生气体通入品红试液中的现象为: 。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________ 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,发生的反应:2MnO4- +16H+ +10Cl- === 2Mn2+ + 5Cl2↑ + 8H2O.现有一个氧化还原反应中,已知反应物和生成物有KCl、H2SO4、KMnO4、MnSO4、H2O、K2SO4、Cl2
(1)已知该反应中,KMnO4得到电子,写出一个包含上述七种物质的氧化还原反应方程式(不需要配平) ;则反应的还原剂为
(2)上述反应中,1mol氧化剂在反应中得到 电子
(3)如果在反应后的溶液中加入NaBiO3,溶液又变回紫红色,请判断下列正确的是
A.氧化性:BiO3->MnO4->Cl2 B.氧化性:BiO3->Cl2>MnO4-
C.氧化性:MnO4->BiO3->Cl2 D.氧化性:Cl2>MnO4->BiO3-
(8分)已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1) 24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
A.非极性共价键 B.极性共价键 C.配位键 D.离子键 E.氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com