
题目列表(包括答案和解析)

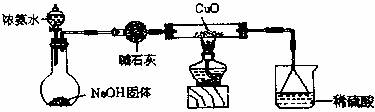
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

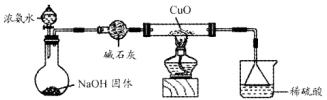
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了![]() mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
利用如图所示的装置和其他必要的仪器用品,完成下列实验。
已知2NH3+3CuO N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是 稀硫酸的作用是 。
(2)浓氨水与固体NaOH接触,为什么会逸出大量氨气?
(3)证明NH3具有还原性的实验现象是
 N2+3Cu+3H2O。
N2+3Cu+3H2O。 mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。 经测定乙醇的化学式是 ,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一.
,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一.

为测定其结构,应利用物质的特殊性进行定性、定量实验,现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四同学们直接利用如图所示装置开始进行实验确定乙醇的结构.
(1)学生甲得到一组实验数据.

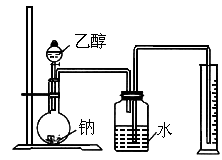
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由为
__________________.
(2)同学乙分别准确称量4.60g乙醇进行多次实验,结果发现以排开量筒内的水的体积作为生成的 体积换算成标准状况后都小于1.12L,如果忽略量筒本身及乙读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?________.
体积换算成标准状况后都小于1.12L,如果忽略量筒本身及乙读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?________.
(3)同学丙认为实验成功的关键有:①装置气密性要良好②实验开始前准确确定乙醇的量③钠足量④广口瓶内水必须充满⑤氢气体积的测算方法正确、数据准确.其中正确的有________(填序号).
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是________.
(5)实验后,四名同学从乙醇的可能结构分析入手对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为nmol,那么对钠的物质的量的取值要求必须是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com