
题目列表(包括答案和解析)
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面。19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3====CaS+Na2CO3
这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外。由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替。索尔维法的生产流程如下:

索尔维法能实现连续生产,但其食盐利用率只有75%,且所得副产品CaCl2没有用处,污染环境。
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品。氯化铵主要用作氮肥。侯德榜制碱法原理是:
①在30~50 ℃的饱和食盐水中,先通入氨至饱和,再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15 ℃,使NH4Cl沉淀,滤液为饱和食盐水。
据此回答下列问题:
(1)标出反应Na2SO4+2C![]() Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①_________________________
②_________________________
③_________________________
④_________________________
(3)写出侯德榜制碱法第①步反应的化学方程式_________________________
(4)在索尔维制碱法中____________物质可循环利用。
(5)在侯德榜制碱法中____________物质可循环利用。
 Na2S+2CO2↑
Na2S+2CO2↑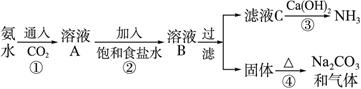
 Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面.19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外.由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替.索尔维法的生产流程如下:
索尔维法能实现连续生产,但其食盐利用率只有70%,且所得副产品CaCl2没有用处,污染环境.
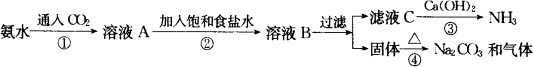
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品.氯化铵主要用作氮肥.侯德榜制碱法的原理是:
①在30~50℃的饱和食盐水中,先通入氨至饱和再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水.
据此回答下列问题:
(1)标出反应Na2SO4+2C![]() Na2S+2CO2↑的电子转移方向和数目.
Na2S+2CO2↑的电子转移方向和数目.
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①________;②________;
③________;④________.
(3)写出侯德榜制碱法第①步反应的化学反应方程式________.
(4)在索尔维制碱法中________物体可循环利用.
(5)在侯德榜制碱法中________物体可循环利用.
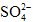 ; ②Na+、Mg2+、Cl-、
; ②Na+、Mg2+、Cl-、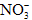 ; ③K+、Ba2+、Cl-、
; ③K+、Ba2+、Cl-、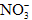 ;
; 


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com