
题目列表(包括答案和解析)
(12分)化工厂生产的某产品只含C、H、O三种元素,分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
(1)该产品的结构简式为___ ____,所含官能团的名称:_____________
(2)该有机物的核磁共振氢谱上有________个峰(信号)
(3)下列物质中,与该产品互为同分异构体的是_____________(填序号,下同)与该产品
互为同系物的是_____________。
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(12分)化工厂生产的某产品只含C、H、O三种元素,分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
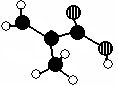
(1)该产品的结构简式为___ ____,所含官能团的名称:_____________
(2)该有机物的核磁共振氢谱上有________个峰(信号)
(3)下列物质中,与该产品互为同分异构体的是_____________(填序号,下同)与该产品
互为同系物的是_____________。
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(12分)化工厂生产的某产品只含C、H、O三种元素,分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。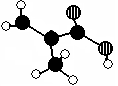
(1)该产品的结构简式为___ ____,所含官能团的名称:_____________
(2)该有机物的核磁共振氢谱上有________个峰(信号)
(3)下列物质中,与该产品互为同分异构体的是_____________(填序号,下同)与该产品
互为同系物的是_____________。
①CH3CH="CHCOOH " ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(12分)工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe (OH) 3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品。
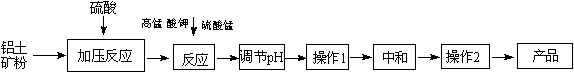
(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为 ▲ 。
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式 ▲ 。实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好。若溶液中亚铁离子和铁离子浓度均为0.03 mol/L,为达到较好的除铁效果,每1 L溶液应加入高锰酸钾的物质的量为 ▲ 。
(3)调节pH的作用是 ▲ 。
(4)操作1的名称为 ▲ ,操作2的名称为 ▲ 。
(5)下列有关工艺的说法正确的是 ▲ 。(填字母序号)
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,但同时会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe (OH) 3


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com