
题目列表(包括答案和解析)
(2002·广东)下列各组物质的主要成分都为硅酸盐的是
[ ]
(2002·广东)煤的气化和液化是高效、清洁地利用煤炭的重要途径,目前不少城市将焦炭在高温下与水蒸气反应制得水煤气,写出该反应的化学方程式__________,固体煤经处理变为气体燃料使用的优点是____________________________________________________.
(2002·广东)对于放热反应 ,下列说法正确的是
,下列说法正确的是
[ ]
A.产物 所具有的总能量高于反应物
所具有的总能量高于反应物 和
和 所具有的总能量
所具有的总能量
B.反应物 和
和 所具有的总能量高于产物
所具有的总能量高于产物 所具有的总能量
所具有的总能量
C.反应物 和
和 所具有的总能量等于产物
所具有的总能量等于产物 所具有的总能量
所具有的总能量
D.反应物 和
和 比产物
比产物 稳定
稳定
(2002·广东)环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息,这些污染物是
[ ]
A.二氧化硫、氮氧化物、一氧化碳、悬浮微粒
B.二氧化硫、氮氧化物、二氧化碳、悬浮微粒
C.稀有气体、氮氧化物、一氧化碳、悬浮微粒
D.稀有气体、氮氢化物、一氧化碳、悬浮微粒
 (2009?广东)磷单质及其化合物的有广泛应用.
(2009?广东)磷单质及其化合物的有广泛应用.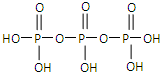
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com