(2011?平顶山二模)碳酸钠俗称纯碱、苏打,是一种常用的日用化学品.在实验室里,可用如图所示装置,以氯化钠、二氧化碳、氨等为原料制备纯碱.实验时,先检验装置的气密性,再向各仪器中加入试剂,打开启普发生器(装置A)活塞,产生二氧化碳气体,制备纯碱.请回答以下有关问题:
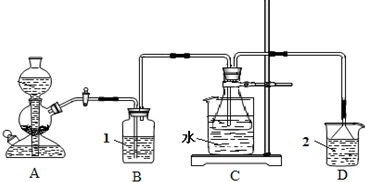
(1)碳酸氢钠受热分解的化学方程式为
;实验时装置A中发生反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;C装置的锥形瓶中,装有含氨的饱和食盐水,则溶液1应为
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,溶液2应为
稀硫酸
稀硫酸
.
(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是
增大二氧化碳的吸收率
增大二氧化碳的吸收率
.化学实验中水浴加热法的优点为
利于控制反应体系的温度和使其受热均匀
利于控制反应体系的温度和使其受热均匀
.
实验时,锥形瓶中产生了NH
4HCO
3、NaCl、NaHCO
3和NH
4Cl的混合液.右表是四种化合物在部分温度下的溶解度.由表中数据可知,反应时水浴的温度不能超过
40
40
℃.反应结束,将反应混合液冷却到15℃左右,析出的固体应主要含有
NaHCO3
NaHCO3
(填化学式).
| 温度 |
10℃ |
20℃ |
30℃ |
40℃ |
| 氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
| 碳酸氢铵 |
15.8 |
21.0 |
27.0 |
分解 |
| 碳酸氢钠 |
8.1 |
9.6 |
11.1 |
12.7 |
| 氯化铵 |
33.3 |
37.2 |
41.4 |
45.8 |
(3)饱和食盐水,还可以通过电解过程制取烧碱.制备过程中,烧碱溶液主要在电解池的
阴
阴
极区产生,原因是
该极区氢离子放电,产生出氢氧根离子
该极区氢离子放电,产生出氢氧根离子
.

