
题目列表(包括答案和解析)
下表A栏中所列各种物质(括号内为少量杂质),在B中选择除杂的方法,在C中选择一种鉴别杂质是否除净的方法.(将序号填入表格中)
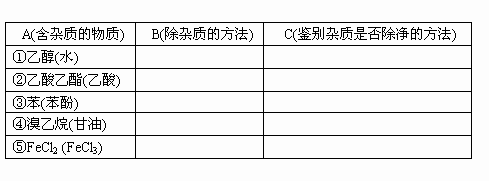
B:(1)过滤 (2)渗析 (3)加入新制CaO后蒸馏 (4)多次水洗分液 (5)加入NaOH溶液振荡后分液 (6)加入饱和Na2CO3溶液振荡后分液 (7)蒸馏 (8)结晶 (9)加入浓溴水产生白色沉淀 (10)加入适量铁粉
C:(a)加入BaCl2产生白色沉淀 (b)加入FeCl3溶液呈紫色 (c)加入AgNO3溶液产生白色沉淀 (d)加入无水CuSO4粉末呈蓝色 (e)加入新制Cu(OH)2悬浊液振荡后呈绛蓝色 (f)使蓝色石蕊试液变红 (g)加入KSCN溶液后呈血红色 (h)加入碘水变蓝
| ||
| ||








(7分)(1)往铜和稀硫酸的混合物中加入双氧水溶液,可以观察到的实验现象是:溶液变蓝,并产生无色气体,请写出涉及这一现象的所有化学反应方程式:
, 。
(2)两个氧化还原反应的离子方程式如下:
① R3++Cl2+6OH-=RO3-+2Cl-+3H2O
② 5RO3-+2Mn2++14H+=5R3++2MnO4-+7H2O
由此 (填“能”或“不能”)得出Cl2的氧化性比MnO4-强的结论,理由是 。
(19分)某物质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体单质,B是有刺激性气味的无色气体。
①组成A的元素在周期表位置为 ;
对应离子的结构示意图为
②写出B→C反应的化学方程式:
③若将B通入品红溶液中,现象 体现了B的
性;若将B通入紫色的石蕊溶液中,现象
体现了B的水溶液的 性。
④D的浓溶液在加热条件下可与铜反应并生成B气体,该反应的化学方程式为:
。
(2)若A在常温下为气体,且能使湿润的红色石蕊试纸变蓝;C是红棕色气体。
①A、C的化学式分别是:A ,C
②写出A→B反应的化学方程式:
③若将A通入滴有酚酞的水中,现象 请用 方程式表示其原因:
方程式表示其原因:
;
④D的浓溶液可与铜反应并生成C气体,则该反应的化学方程式为:
。
(共 11 分)
(1)有一种叫做钾长石(K2Al2Si6O16),其化学式为写成氧化物的形式为______________
(2)反应3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O的离子方程式为:
每生成11.2L标准状况下的气体,被还原的 (填名称)的质量为 g。
得电子与失电子个数比是_____,被氧化与被还原的原子的个数比为______,试用“单线桥”标出该反应电子转移方向和数目:_____________________________
![]() (3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
① A + H2O → B + C ② C + F → D ③ D + NaOH → F + E + H2O
写出A 、B、 C的化学式A______ B ____ C______
写出反应③的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com