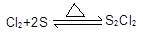硫代硫酸钠(Na
2S
2O
3)可由下面一系列反应制得:
①Na
2CO
3+SO
2 =Na
2SO
3+CO
2②Na
2S+SO
2+H
2O=Na
2SO
3+H
2S
③2H
2S+SO
2=3S↓+2H
2O
④Na
2SO
3 + S

Na
2S
2O
3,
常温下溶液中析出晶体为Na
2S
2O
3?5H
2O。Na
2S
2O
3·5H
2O于40~45℃熔化,48℃分解;
Na
2S
2O
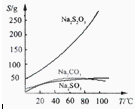
3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
Ⅰ.现按如下方法制备Na
2S
2O
3·5H
2O:
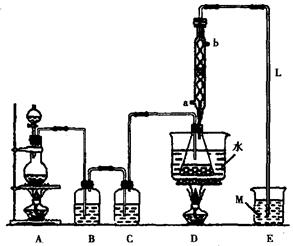
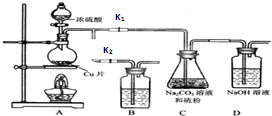
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
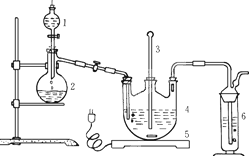
请问:仪器2的名称为
,
装置6中可放入
。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
Ⅱ.分离Na
2S
2O
3·5H
2O并标定溶液的浓度:
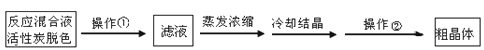
(1)为减少产品的损失,操作①为
,操作②是
、洗涤、干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K
2Cr
2O
7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:

6I
-+Cr
2O
72-+14H
+=3I
2+2Cr
3++7H
2O,再加入几滴淀粉溶液,立即用所配Na
2S
2O
3溶液滴定,发生反应: I
2+2S
2O
32-=2I
-+S
4O
62-,滴定终点的现象为
,
三次消耗Na
2S
2O
3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为
mol/L。

 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-. Na2S2O3,
Na2S2O3,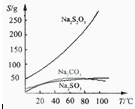


 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 , Na2S2O3,
Na2S2O3,


 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,