
题目列表(包括答案和解析)
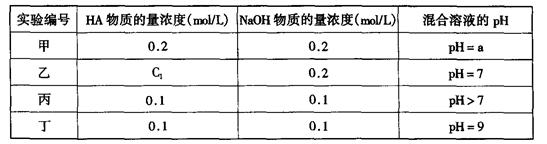
(11分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | C(HA)=0.2 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=a |
| 乙 | C(HA)=c1 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=7 |
| 丙 | C(HA)="0.1" mol·L-1 | C(NaOH)=0.1mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
(11分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH—)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A—)= mol/L
(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:

请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 ;
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 ;
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”);
该混合溶液中离子浓度由大到小的顺序是 ;
(4)丁组实验所得混合溶液中由水电离出的c(OH—)= mol/L;
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A—)= mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com