
题目列表(包括答案和解析)
本题包括两个小题,共16 分。
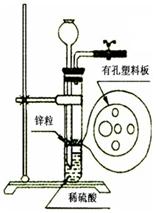
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
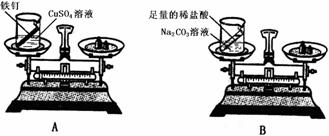
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
本题包括两个小题,共16 分。
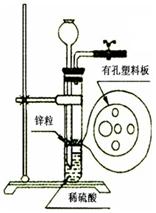
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
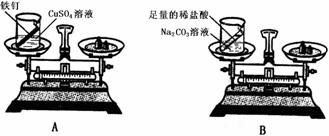
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
(1)汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。

下列说法中正确的是 。
A.该反应是置换反应
B.该反应中乙被氧化了,发生了还原反应
C.每生成2mol生成物,该反应共转移16/5mol电子
D.使用催化净化器的汽车必须使用无铅汽油,因为含铅化合物会使催化剂中毒
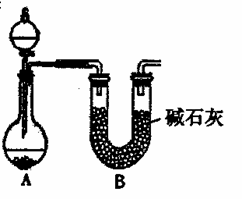
 (2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
(2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
①若A中使用的药品是碳酸氢铵,则在下列仪器中,A中未画出的仪器有 (填序号)。
a.乱分液漏斗 b.试管 c.烧瓶 d.酒精灯 e.导气管 f.橡胶塞
②装置B的作用是: 。
③装置C中发生反应的化学方程式为 。
④若A、B中药品足量,则装置D中可以观察到的现象是 。
 ⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.
;
⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a.
;
b. 。
(3)一些同学提出也可将上述所示装置中A、B
部分换成右图所示装置进行实验。则反应开
始前:
①分液漏斗中盛放的药品是 ;
②烧瓶中发生反应的化学方程式为:
。
(1)汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。

下列说法中正确的是 。
A.该反应是置换反应
B.该反应中乙被氧化了,发生了还原反应
C.每生成2mol生成物,该反应共转移16/5mol电子
D.使用催化净化器的汽车必须使用无铅汽油,因为含铅化合物会使催化剂中毒
 (2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
(2)NH3的催化氧化也可产生NO,某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置略去)。
①若A中使用的药品是碳酸氢铵,则在下列仪器中,A中未画出的仪器有 (填序号)。
a.乱分液漏斗 b.试管 c.烧瓶 d.酒精灯 e.导气管 f.橡胶塞
②装置B的作用是: 。
③装置C中发生反应的化学方程式为 。
④若A、B中药品足量,则装置D中可以观察到的现象是 。
 ⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a. ;
⑤指导老师从安全与环保的角度考虑,指出该装置有两处明显的缺陷。请你提出修改建议:a. ;
b. 。
(3)一些同学提出也可将上述所示装置中A、B
部分换成右图所示装置进行实验。则反应开
始前:
①分液漏斗中盛放的药品是 ;
②烧瓶中发生反应的化学方程式为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com