
题目列表(包括答案和解析)

金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。
(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是????????? 态(填气、液、固)。把钠的物质的量分数为20%的0.2mol的此合金安全地加入到重水(D2O)中,产生的气体物质所含的中子数为???????????? 。
(2)镁铝合金是经常见到的轻质合金。剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的电子式是??????????? 。当一块5.1g的镁铝合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氢氧化钠溶液的体积???????????? mL至沉淀质量不再改变,如整个过程中有0.5mol 的电子发生转移,则合金中Mg的物质的量分数为????? 。
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是??????????????????????????????????????? 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有??????? 。

碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗涤、烘干、称量。洗涤沉淀的操作是 ______________________________ 。
方案二:气体分析法
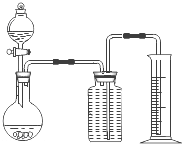
(2)把一定量的样品与足量盐酸反应后,用下图装置测定产生CO2气体的体积,为了测量结果准确,B中的溶液最好采用___________________,但选用该溶液后实验结果仍然不够准确,其原因是_______________________。
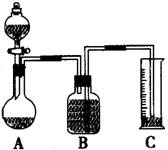
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度。
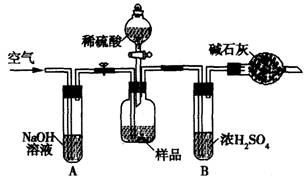
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为mg ②取ng样品装入广口瓶中
③检验装置的气密性 ④缓慢鼓人空气数分钟,再称量干燥管质量为Mg ⑤关闭止水夹
⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓人空气数分钟
Ⅰ.正确的操作顺序是(填写序号):③→_________→⑥→______⑤→________⑦→______
Ⅱ.在操作④中,要缓慢鼓人空气数分钟,鼓人空气的作用是_________ ;装置A的作用是 _________;装置B的作用是 _____________。
Ⅲ.若去掉装置A,测定结果______________ ;若去掉装置B,测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(1)上述事实说明了什么问题?
(2)1989年世界卫生组织把铝确定为食品污染源之一,每日摄入量应控制在4 mg以下,问铝元素含量较多会引发什么疾病?
(3)油条是我国北方常见食品之一,油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”“矾”和“盐”分别指什么物质?写出炸油条时“矾”和“碱”之间反应的化学方程式。
(4)炸油条时1 kg面粉需加0.51 kg水、4 g“矾”、10 g“碱”和“盐”等辅料。若在烹炸过程中质量减少20%,试通过计算说明100 g油条中的含铝量是否超过安全摄入量?
(5)因铝在人体内积累有害健康,因此市场上已有“无铝发泡剂”商品出售,这类发泡剂仍是CO2发泡,如NaH2PO4和小苏打便是其中的一种。“无铝发泡剂”的发泡原理是________________________________(用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com