
题目列表(包括答案和解析)
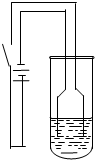 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO |
氢氧化亚铜 | 橙黄色,不稳定 |
| ||
| ||
| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO | 氢氧化亚铜 | 橙黄色,不稳定 |

 某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO | 氢氧化亚铜 | 橙黄色,不稳定 |
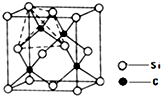 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质]
 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com