
题目列表(包括答案和解析)
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。

已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
|
物质 |
TiCl4 |
FeCl3 |
SiCl4 |
AlCl3 |
|
沸点/℃ |
136 |
310 |
56.5 |
180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ•mol-1 ;反应的平衡常数表达式K=
,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ•mol-1 ;反应的平衡常数表达式K=
,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。

(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g)△H=+151kJ•mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ•mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
(4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S04 25mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是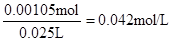 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2++ O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O。
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:

(1)(3分)实验中观察到的现象是__________________________
(2)(3分)产生上述现象的原因是_______________;
(3)(2分)写出有关的离子方程式:_______________________。
(4)(2分)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
【解析】在金属活动顺序表中镁位于氢的前面,和酸反应能置换出氢气。金属和酸的反应一般是放热反应,所以饱和石灰水的温度要升高,但氢氧化钙的溶解度随温度的升高而降低,所以会有晶体析出。反应放热,说明反应物的总能量高于生成物的总能量。
(11分)某研究性学习小组为证明2Fe3+ + 2I- 2Fe2++ I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是 。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是 。
方案乙:
取5mL0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到 现象,即可证明该反应为可逆反应,请解释产生该现象的原因 。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向 方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为 。
【解析】(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ +2I- 2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com