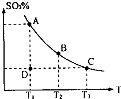
(1)在硫酸生产中,SO
2催化氧化生成SO
3是反应的关键,其反应的化学方程式为:2SO
2(g)+O
2(g)?2SO
2(g),反应混合体系SO
3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
①反应2SO
2(g)+O
2(g)?2SO
2(g)的△H
0(填“>”或“<”).若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO
3气体,容器内的压强
(填“增大”、“减小”或“不变”),平衡
移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通入大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO
2的物质的量
(填“增大”、“减小”或“不变”),O
2的物质的量浓度
(填“增大”、“减小”或“不变”).
②若温度为T
1、T
2,反应的平衡常数分别为K
1K
2 则K
1
K
2(填“>”、“<”或“=”),反应进行到D点状态时,V
正
V
逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20mol SO
2和0.10mol O
2,在500℃开始反应,半分钟达到平衡,测得容器内含SO
3 0.18mol,则v(O
2)=
mol?L
-1?min
-1,若继续通入0.20mol SO
2和0.10mol O
2,平衡发生了移动,再次达到平衡后,
mol<n(SO
3)<
mol.
(2)已知三种无色溶液:a.NaHCO
3溶液,b.AlCl
3溶液,c.NaAlO
2溶液,它们两两反应均能生成Al(OH)
3沉淀.请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH
-)=
(K
w是水的离子积),则这两种溶液可为
(填字母).
②能体现出NaHCO
3在反应中,HCO
-3的水解程度小于电离程度的离于方程式为
.

 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: