配制400mL0.1mol/L的Na
2CO
3溶液:
(1)计算:需无水Na
2CO
35.3
5.3
g. (2)称量:用天平称量无水Na
2CO
35.3
5.3
g.
(3)溶解:所需仪器
烧杯、玻璃棒
烧杯、玻璃棒
.
(4)转移:将烧杯中的溶液沿
玻璃棒
玻璃棒
小心地引流到
容量瓶
容量瓶
中.
(5)定容:当往容量瓶里加蒸馏水时,距刻度线
1-2
1-2
cm处停止,为避免加水的体积
过多,改用
胶头滴管
胶头滴管
加蒸馏水到溶液的
凹液面
凹液面
正好与刻度线
相切
相切
,这个操作叫做定容.
(6)不能配制任意体积的一定物质的量浓度的溶液,这是因为
容量瓶的容积固定
容量瓶的容积固定
.
(7)溶液注入容量瓶前需恢复到室温,这是因为
溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高.
溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高.
.
(8)用胶头滴管定容后再振荡,出现液面底于刻度线时不要再加水,这是因为
再加水导致溶液的体积偏大,配制溶液的浓度偏小.
再加水导致溶液的体积偏大,配制溶液的浓度偏小.
.
(9)如果加水定容时超出了刻度线,不能将超出部分再吸走,须
重新配制
重新配制
.
(10)如果摇匀时不小心洒出几滴,不能再加水至刻度,必须重新配制,这是因为
再加水至刻度导致溶质的物质的量偏小,配制溶液的浓度偏低.
再加水至刻度导致溶质的物质的量偏小,配制溶液的浓度偏低.
.
(11)溶质溶解后转移至容量瓶时,必须用少量蒸馏水将烧杯及玻璃棒洗涤2-3次,并将洗涤液一并倒入容量瓶,这是因为
如果不将洗涤液倒入容量瓶会导致溶质的物质的量偏小,配制溶液的浓度偏低.
如果不将洗涤液倒入容量瓶会导致溶质的物质的量偏小,配制溶液的浓度偏低.
.

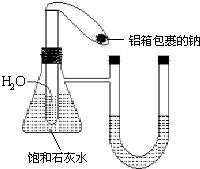 在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.
在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.