
题目列表(包括答案和解析)
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:孔雀石为4∶1;石青为3∶1。则它们的化学组成为:
孔雀石:________________,石青:__________________。
(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO23.36L(标准状况);加热B样品使其完全分解,得到20 g CuO。试计算并确定该矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO26.72L(标准状况),这份矿样中CuO含量不低于___________克。
(4)设某碳酸盐类铜矿样的质量为A克,所含CuO质量为G克。加酸完全溶解后,产生的CO2体积(标准状况)为V升,则含铜矿样的A、V、G之间的关系式为:A=___________。
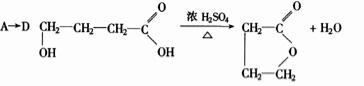
试写出:
化学方程式A→D ,B→C 。
反应类型A→B B→C A→E 。
E的结构简式 。
A的同分异构体(同类别且有支链)的结构简式: 及 。
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com