
题目列表(包括答案和解析)
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ______ | ______ | ______ | ______ | ||||
| 3 | ______ | ______ | ______ | ______ | ______ | ______ | ||
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
| ||
| ||
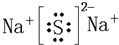
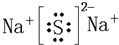


元素编号 | a | b | c | d | e | f | g | h |
原子半?径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合价或最低化合价 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
根据元素周期律,判断下列推断不正确的是
A.元素a与元素c形成的化合物分子中的化学键是极性键
B.b元素形成的氢化物分子间存在氢键
C.e元素位于周期表中的第二周期ⅥA族
D.元素f的最高价氧化物的水化物能溶于元素h的最高价氧化物的水溶液中
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式。
(2)用甲和单质D2可设计呈燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为______________________________。
(3)
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是_______________。
(5)常温下向25 mL 0.1 mol·L-1丙溶液中逐滴滴加0.1 mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:

①图中m点由水电离出的OH-的物质的量浓度为___________________;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为_____________________。
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)元素E的外围电子排布式:_______________
(2)元素B与D的电负性的大小关系是___________,C与D的第一电离能的大小关系是
___________。(填﹥、﹤、﹦,用元素符号表示)
(3) B、D两元素组成的极性分子和C元素形成的单质互为等电子体,则B、D两元素组成的极性分子的结构式为____________________。
(4 )A和D按原子个数比1 : 1形成的化合物是 分子(填极性和非极性)
(5)写出由A、B、C、D四种元素组成的离子化合物和共价化合物的化学式(各写出1种即可)
_____________________ 、
(6)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,
请写出该反应的离子方程式:___________________________________________。
(1)3S23P3 (2)C<O N>O(3)C=O (4)极性 (5)(NH4)2CO3、NH4HCO3 CH3NO2任写一种 (6)OH-+HCO3-=CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com