某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)该学生的实验操作如下:
A.用碱式滴定管取待测NaOH溶液25.00mL,注入锥形瓶中,加入2滴酚酞.
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管用标准液的润洗后,将标准液注入酸式滴定管刻度“0”以上2-3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作2次
G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→
C
C
→D→
B
B
→
A
A
→
G
G
→F;
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
锥形瓶内溶液的颜色变化
锥形瓶内溶液的颜色变化
_.直到因加入一滴盐酸后,溶液由红色变为无色,并且
浅红色变为无色且半分钟内不褪色
浅红色变为无色且半分钟内不褪色
为止;
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
D
D
;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
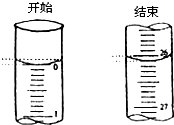
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为
0.00
0.00
mL,终点读数
26.10
26.10
mL;
(5)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 |
待测氢氧化钠
溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
| 滴定前刻度 |
滴定后刻度 |
溶液体/mL |
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
0.1044mol/L
0.1044mol/L
.
(6)有一学生在实验室测某碱溶液的pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测.
①该学生的操作是
错误
错误
(正确或错误).
②如不正确,请分析是否一定有误差,为什么?
溶液被稀释氢离子或氢氧根离子浓度发生了变化
溶液被稀释氢离子或氢氧根离子浓度发生了变化
.
③若用此法分别测定c(H
+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是
盐酸
盐酸
,原因是
盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
.

 回答酸碱滴定实验中的下列问题:
回答酸碱滴定实验中的下列问题: 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: