
题目列表(包括答案和解析)
下面是以铝屑为原料制备Al(OH)3的三种实验设计方案:
方案一:用稀硫酸跟铝屑反应,使铝转化成Al3+的溶液,再用NaOH溶液使Al(OH)3沉淀析出。
方案二:将铝屑与NaOH溶液反应,再用稀硫酸中和过量的碱液,与[Al(OH)4]-反应以得到Al(OH)3。
方案三:用铝屑分别与稀硫酸和浓NaOH溶液反应,然后将得到的盐溶液混合过滤,再将得到的沉淀洗涤,即可得到Al(OH)3。
综合比较以上三种实验设计方案,你认为哪种方案最好?

 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
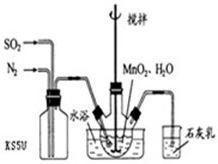 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.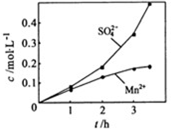

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com