
题目列表(包括答案和解析)
(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 ;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
某有机物A的分子式为C6H8O7,对其进行如下实验。
①将 1.92 g A与100 mL 0.3 mol/L碳酸氢钠溶液混合,恰好反应。
②在一定条件下,能与乙酸发生酯化反应。
请根据题目要求回答问题。
(1)推测A的分子结构中具有的官能团 (写名称)。
(2)若经测定A的结构中无甲基,则A可能的结构简式有 种。其中一种结构为柠檬酸,已知柠檬酸结构中相同的官能团不是连接在同一个碳原子上,且柠檬酸在铜催化条件下不会被氧化,则柠檬酸的结构简式为 。
(3)写出柠檬酸与足量碳酸氢钠溶液反应的化学方程式 。
(4)在一定条件下柠檬酸可以发生化学反应的类型有 (填序号)。
A.取代反应 B.加成反应 C.消去反应 D.中和反应 E.加聚反应
(5)柠檬酸和部分有机物的熔沸点见下表
| 乙酸 | 乙醇 | 乙酸乙酯 | 柠檬酸晶体 | 柠檬酸乙酯(液体) | |
| 沸点(℃) | 118 | 78.5 | 77.1 | 294 | |
| 熔点(℃) | 153 | ―55 |
由数据分析柠檬酸与乙醇发生酯化反应,用如下图的装置,在试管②中,能否收集到柠檬酸乙酯(填“能”或“不能”),原因是 。
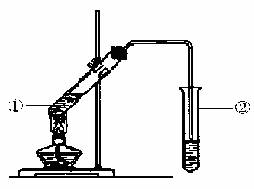
(6)写出柠檬酸与足量乙醇完全酯化反应的化学方程式 。
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: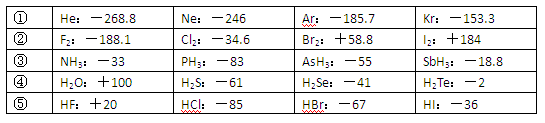
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
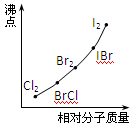
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示:
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
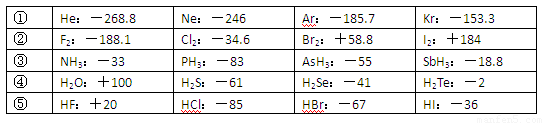
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。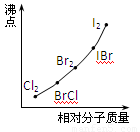
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com