
题目列表(包括答案和解析)
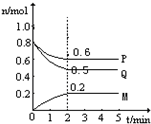 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
| 13 |
| 16 |
| 13 |
| 16 |
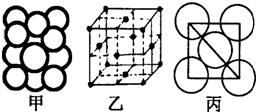 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.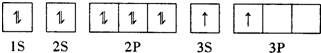
(6分)将2.4mol某金属投入1.8L 2mol/L的盐中,恰好完全反应,并得到7.2gH2,则某金属的化合价为 ,酸为 元酸。
将2.4mol某金属投入1.8L 2mol/L的酸中,恰好完全反应,并得到7.2gH2,则某金属的化合价为 ,该酸为 元酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com