已知某无色透明溶液中仅含有包括Na
+和CH
3COO
-在内的四种离子.请回答下列问题.
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
①
CH3COONa
CH3COONa
;②
CH3COONa和CH3COOH
CH3COONa和CH3COOH
; ③
CH3COONa和NaOH
CH3COONa和NaOH
.
(2)用离子方程式表示CH
3COONa溶液显碱性的原因:
CH
3COO
-+H
2O

CH
3COOH+OH
-CH
3COO
-+H
2O

CH
3COOH+OH
-;
(3)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(写出两种):①
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
、②
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
;
(4)当溶液中各离子浓度大小的顺序为c(CH
3COO
-)>c(Na
+)>c(H
+)>c(OH
-)时,则该溶液可能是
C
C
(填序号).
A.由0.1mol/L的CH
3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.由0.1mol/L的CH
3COONa溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.1mol/L的CH
3COONa溶液与0.1mol/L的CH
3COOH溶液等体积混合而成.

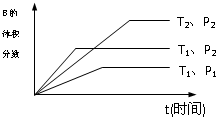 已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行. CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-