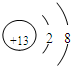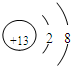X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为
O
O
;M在元素周期表中的位置为
第三周期第ⅢA族
第三周期第ⅢA族
;五种元素的原子半径从大到小的顺序是
Al>C>N>O>H
Al>C>N>O>H
(用元素符号表示).
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,已知:气态的B在L常见的单质中燃烧生成Z单质和水蒸气时放出534KJ能量,试写出该反应热化学方程式
N2H4(g)+O2(g)═N2(g)+2H2O(g)?△H=-534kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)?△H=-534kJ/mol
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的最高价氧化物对应的水化物化学式为
H2SeO4
H2SeO4
,该族2~5周期元素单质分别与H
2反应生成1 mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是
b
b
(填字母代号).
a.+99.7mol?L
-1 b.+29.7mol?L
-1c.-20.6mol?L
-1 d.-241.8kJ?mol
-1(4)用M单质作阳极,石墨作阴极,NaHCO
3溶液作电解液进行电解,生成难溶物R和某气体,已知R受热分解生成化合物Q.写出阳极生成R的电极反应式:
Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑
Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑
;由R生成Q的化学方程式:
.