
题目列表(包括答案和解析)
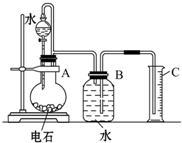 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.| 0.29V |
| W |
| 0.29V |
| W |
| A、除去工业废水中的Cu2+可以选用FeS作沉淀剂 | B、向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 | C、因为H2SO4是强酸,所以反应:CuSO4+H2S=CuS↓+H2SO4不能发生 | D、将足量的CuSO4溶解在0.1mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
 2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com