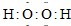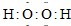(2011?天津模拟)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
族
周期 |
IA |
|
0 |
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
|
|
⑦ |
⑧ |
|
Ⅰ.(1)请画出元素⑧的离子结构示意图
.
(2)元素⑦中质子数和中子数相等的同位素符号是
1632S
1632S
.
(3)④、⑤、⑦的原子半径由大到小的顺序为
Na>S>O
Na>S>O
.
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为
HClO4
HClO4
>
H2SO4
H2SO4
.
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为
.
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧性化单质,则A不可能是
de
de
(填序号).
a.S b.N
2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO
3溶液,产生不溶于稀HNO
3的白色沉淀,检验此C溶液中金属离子的化学试剂和现象分别是
KSCN溶液和氯水;滴加KSCN溶液不显红色,再加入氯水显红色(或者加NaOH溶液,先产生白色沉淀,迅速变成灰绿色,最后变成红褐色)
KSCN溶液和氯水;滴加KSCN溶液不显红色,再加入氯水显红色(或者加NaOH溶液,先产生白色沉淀,迅速变成灰绿色,最后变成红褐色)
;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式
H2O2+2Fe2++2H+═2Fe2++2H2O
H2O2+2Fe2++2H+═2Fe2++2H2O
.
(3)若A,B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
Al(OH)3
Al(OH)3
,写出A与C两溶液反应的离子方程式
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.