
题目列表(包括答案和解析)
 (2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.| 元素 | Mn | Fe | |
| 电离能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)

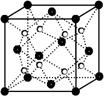
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
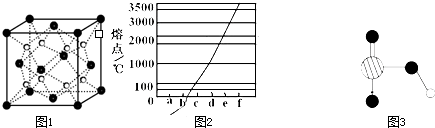
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。

(16分)元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_________(填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。

(4)由叠氮酸钠(NaN3)热分解可得光谱纯N2:2NaN3(s)===2Na(l)+3N2(g),下列有关说法正确的是 (选填序号)。
A.NaN3与KN3结构类似,前者晶格能较小
B.金属钠的晶胞结构如图所示,每个晶胞平均分摊2个钠原子

C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com