
题目列表(包括答案和解析)
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 浓硫酸 |
| 170摄氏度 |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
| 加热 |
| 加热 |
(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: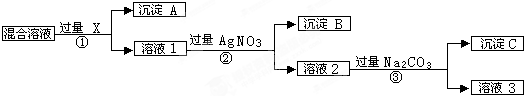
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
(9分,每空1分)元素A—D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远。 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 | 单质常温、常压下是气体,原子的L层有一个未成对的p电子。 | +2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是__ _(填元素符号) ,写出D离子的电子排
布式
⑵用电子式表示D和C形成的化合物的形成过程
写出C单质与水反应的化学方程式_____________________________________
⑶对元素B的单质或化合物描述正确的是_________ 。
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
⑷A在一定条件下发出黄光是A原子的电子从能量 跃迁到能量
所释放的能量
(5)A和D量元素金属性较强的是(写元素符号)_______ 。写出能证明该结论的一个实验事实______________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com