
题目列表(包括答案和解析)


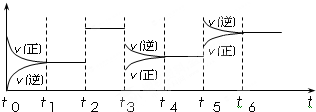
| A、钢铁腐蚀时可能发生的正极反应:4OH--4e-═2H2O+O2↑ | ||||||
| B、表示中和热的离子方程式:H++OH-═H2O;△H=-57.3kJ/mol | ||||||
| C、明矾水解反应的离子方程式:Al3++3H2O═Al(OH)3+3H+ | ||||||
D、硫酸铵溶液与氢氧化钠溶液混合共热的离子方程式:N
|
下列过程都与热量变化有关,其中表述不正确的是:
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为
CO (g)+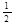 O2(g)
O2(g) CO2
(g);△H=—283.0 kJ/mol
CO2
(g);△H=—283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为
1/2H2SO4(aq)+ 1/2Ba(OH)2(aq)=BaSO4(s)+H2O(l);△H= —57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
下列过程都与热量变化有关,其中表述不正确的是 ( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:
CO(g)+ O2(g)= CO2(g);△H = −283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为:
H2SO4(l)+ KOH(l)= K2SO4(l)+H2O(l);△H = -57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com