
题目列表(包括答案和解析)
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题: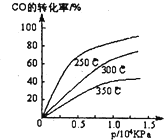 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
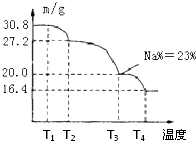 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com