
题目列表(包括答案和解析)
目前我国合成一种含铊(Tl)的超导材料,铊原子的核外电子排布为2、8、18、32、18、3。下列说法不正确的是( )
![]() A.不能置换酸中的氢 B.铊位于元素周期表的第6周期ⅢA族
A.不能置换酸中的氢 B.铊位于元素周期表的第6周期ⅢA族
![]() C.铊的熔点比铝的熔点低 D.它的最高价氧化物的水化物为Tl(OH)3
C.铊的熔点比铝的熔点低 D.它的最高价氧化物的水化物为Tl(OH)3
我国曾经报道合成一种含铊的超导材料,铊(T1)原子的核外电子排布为 ,试推断铊在元素周期表中位于第________周期,________族,最高正价为________,其最高价氧化物的化学式为________;其对应的水化物的化学式为________,应属于________(酸,碱,两性氢氧化物).
,试推断铊在元素周期表中位于第________周期,________族,最高正价为________,其最高价氧化物的化学式为________;其对应的水化物的化学式为________,应属于________(酸,碱,两性氢氧化物).
我国曾经报导合成一种含铊的超导材料,铊(Tl)原子的核外电子排布为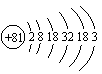 :判断铊在周期表中的位置和性质
:判断铊在周期表中的位置和性质
(1)Tl在元素周期表中位于第________周期,________族,最高价氧化物的化学式为________水化物的化学式为________,分类是属于________(酸、碱、两性氢氧化物).
(2)Tl的熔点比地壳中含量最多的金属元素________的熔点________(高、低),Tl单质的还原性比该金属的还原性________(强、弱).
| 1 | 2 |
(15分)高聚物E是常见的一次性塑料包装袋的主要成分,它的合成路线如下:
请回答下列问题:
(1)已知:烃A的蒸气对氢气的相对密度为39,则A的最简式为 ▲ 。
(2)由A生成B的反应类型是 ▲ ;写出由C生成D的方程式 ▲ 。
(3)已知化合物G(C8H6O4)是B的一种同分异构体与酸性高锰酸钾溶液反应后的产物,G的核磁共振氢谱有两组峰,且峰面积比为l:2,写出G的结构简式 ▲ 。
(4)在F的同分异构体中,含三个甲基的共有 ▲ 种。
(5) 一次性塑料包装袋给我们生活带来便利的同时也带来了“白色污染”。 最近我国科学院以麦芽为原料,研制出的一种新型高分子可降解塑料――聚丁内酯(其结构: ),它可代替高聚物E,以减少“白色污染”。聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
①写出环丁内酯的结构简式: ▲ ;
②写出图中①的相应化学方程式 ▲ 。
③ I在一定条件下可以合成一种重要化工原料J:
写出由I合成J的路线流程图(无机试剂任选)。
合成路线流程图书写示例如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com