
题目列表(包括答案和解析)
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 |
固体完全溶解 |
|
步骤2:往Ⅰ试管中加入 ,再滴加 。 |
,则证明生成 物中含Na2SO4。 |
|
步骤3:往Ⅱ试管中 。 |
若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol·L-1碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
②计算:生成物中亚硫酸钠的质量分数为 。(Na2SO3的式量为126)
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 。 | ,则证明生成 物中含Na2SO4。 |
| 步骤3:往Ⅱ试管中 。 | 若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
请按要求回答下列问题:
(1).某合作学习小组讨论辨析以下说法,其中说法正确的是 _____________
A根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
B 将Na2O2投入FeCl2溶液中, 可观察到的现象是生成红褐色沉淀、有气泡产生
C 金属元素的原子只有还原性,离子只有氧化性
D不锈钢和目前流通的硬币都是合金;
E NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为_____________
(3)在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,
氧化剂是_____ _(填化学式) 当有14.6gHCl被氧化时,电子转移为 mol。
(4)学校研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列实验方案进行探究,填写下列空白:
实验方案:铝镁合金 ![]()
![]() 测定剩余固体质量。
测定剩余固体质量。
① 实验中发生反应的化学方程式是__________________。
② 实验步骤:称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH 溶液中充分反应。计算所用NaOH溶液的体积V≥______________。
过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________( 填 不变 偏高 或 偏低 )。
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题: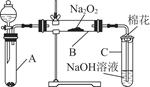
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| | 若 , |
| 则证明生成物中有Na2SO3;若 | |
| | |
| 则说明生成物中没有Na2SO3。 | |
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
实验步骤 | 预期现象和结论 |
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
步骤2:往Ⅰ试管中加入 ,再滴加 | , |
则证明生成物中含Na2SO4 |
|
步骤3:往Ⅱ试管中 |
|
| 若 , |
则证明生成物中有Na2SO3;若 |
|
|
|
则说明生成物中没有Na2SO3。 |
|
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com