
题目列表(包括答案和解析)
|
亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2→4ClO2↑+H++Cl—+2H2O.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,速度变化的原因是 | |
| [ ] | |
A. |
逸出ClO2使生成物浓度降低 |
B. |
酸使亚氯酸的氧化性增强 |
C. |
溶液中的H+起催化作用 |
D. |
溶液中的Cl—起催化作用 |
亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2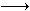 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
| A.逸出ClO2使生成物浓度降低 | B.酸使亚氯酸的氧化性增强 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2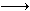 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
A.逸出ClO2使生成物浓度降低 B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用 D.溶液中的Cl-起催化作用
 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。| A.逸出ClO2使生成物浓度降低 | B.酸使亚氯酸的氧化性增强 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com