
题目列表(包括答案和解析)
C2H2(g)+H2(g)![]() C2H4(g) (1)
C2H4(g) (1)
2CH4(g)![]() 2H2(g)+C2H4(g) (2)
2H2(g)+C2H4(g) (2)
据此判断以下3个热化学方程式中
C(s)+2H2(g)![]() CH4(g) DH 1=-Q1 ①
CH4(g) DH 1=-Q1 ①
2C(s)+H2(g)![]() C2H2(g) DH 2=-2Q2 ②
C2H2(g) DH 2=-2Q2 ②
2C(s)+2H2(g)![]() C2H4(g) DH 3=-2Q3 ③
C2H4(g) DH 3=-2Q3 ③
热量Q1、Q2、Q3由大到小的正确顺序是( )
A.Q1、Q2、Q3 B.Q1、Q3、Q2
C.Q3、Q2、Q1 D.Q2、Q1、Q3
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
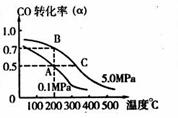
(2)在10L密闭容器中充有10 molCO 与20molH2,
在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )
)
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-242.0kJ?mol-1
O2(g)=H2O(g) △H=-242.0kJ?mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ?mol-1
O2(g)=CO2(g) △H=-283.0kJ?mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汽反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
(已知:①CO(g)+ ![]()
![]() O2(g)=CO2(g) △H=-283.0KJ·mol-1
O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1 )
此反应的热化学方程式是 。
(2)硫—碘循环分解水制氢,主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI II 2HI ![]() H2+I2
H2+I2
III 2H2SO4====2SO2+O2+2H2O
分析上述反应,下列判断正确的是 。、
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1 molH2
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为 。
(5)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
上述冶炼过程产生大量SO2。下列处理SO2的方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com