
题目列表(包括答案和解析)
(10分)
(1)在上面元素周期表中全部是金属元素的区域为___________。
| A.a | B.b | C.c | D.d |
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度0C | 10 | 30 | 40 |
| CaSO4 | 0.19 | 0.21 | 0.21 |
| ||
| ||
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度0C | 10 | 30 | 40 |
| CaSO4 | 0.19 | 0.21 | 0.21 |
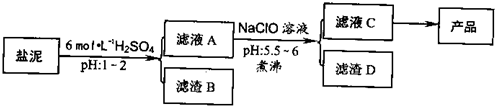
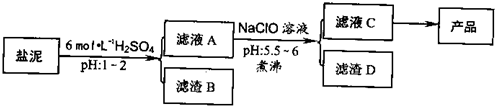
氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%。氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
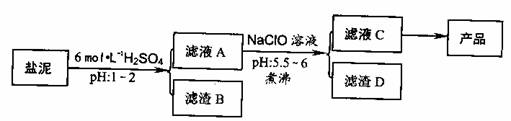
部分阳离子以氢氧化物沉淀时溶液pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 11.2 |
溶解度表
温度0C | 10 | 30 | 40 |
CaSO4 | 0.19 | 0.21 | 0.21 |
回答下列问题:
(1)滤渣B的主要成分是:__________________
 (2)从滤渣A得到滤液C,能否用氨水代替NaClO?_________,说明理由________,其中加热煮沸的目的是_________________
(2)从滤渣A得到滤液C,能否用氨水代替NaClO?_________,说明理由________,其中加热煮沸的目的是_________________
(3)从滤液C中获得产品经过3个操作步骤,分别是________,________,_______
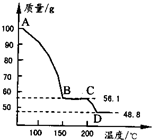
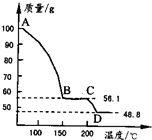
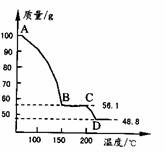
(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如右图所示。据图写出CD段反应的化学方程式__________________。
(12分) 锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:

试回答下列问题
(1)锰在元素周期表中第 周期,第 族。
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式 。
(3) 步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是____________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6 。)
___________________________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是______________________________________________。
(4) 已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com