
题目列表(包括答案和解析)
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K.工业上制备无水FeCl3的一种工艺如下:
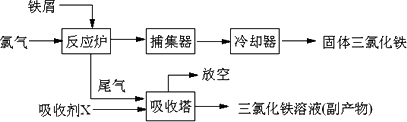
(1)试写出吸收塔中反应的离子方程式:________.
(2)已知六水合氯化铁在水中的溶解度如下:
从FeCl3溶液中获得FeCl3·6H2O的方法是:________.
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=________mol/L(已知:Ksp[Fe(OH)3]=1.1×10-36).
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250 mL容量瓶,用蒸馏水定容;取出25 mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL.
(已知:2Fe3++2I-=I2+2Fe2+ I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:________.
②滴定至终点,实验数据如下表所示:(第一次滴定终点的数据如下图中c点所示,请将你读得的数据填入表中)
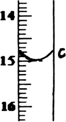
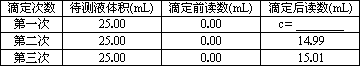
则样品中氯化铁的质量分数为________(写出最终的计算结果).
③下列操作可能使测定结果偏低的是________.
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数

 CH3OH(g);ΔH
CH3OH(g);ΔH 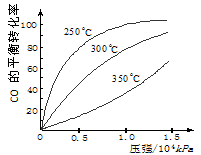
(15分)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一]取样品0.100 g,用右图所示实验装置进行测定。(夹持装置省略)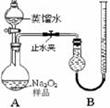
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准状况),则样品中Na2O2的纯度为 。
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250 mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
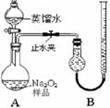
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com