
题目列表(包括答案和解析)
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L 平底烧瓶 C、0.5L 容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
(共14分)Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁。
(1)a电极材料为 ,该电极反应式
(2)若白色沉淀在电极上生成,则电解液d是 ,
若白色沉淀在两极之间的溶液中生成,则电解液d是________
(填字母代号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)液体c为苯,其作用是
(4)若在两极之间的溶液中能短时间内看到白色沉淀,可以采取的措施是________________。
A、改用稀硫酸做电解液 B、适当增大电源电压 C、适当降低电解液温度
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L 平底烧瓶 C、0.5L 容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
(共14分)Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁。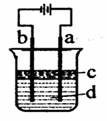
(1)a电极材料为 ,该电极反应式
(2)若白色沉淀在电极上生成,则电解液d是 ,若白色沉淀在两极之间的溶液中生成,则电解液d是________(填字母代号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)液体c为苯,其作用是
(4)若在两极之间的溶液中能短时间内看到白色沉淀,可以采取的措施是________________。
A、改用稀硫酸做电解液 B、适当增大电源电压 C、适当降低电解液温度
(每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L平底烧瓶 C、0.5L容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com