
题目列表(包括答案和解析)
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源k.s.5.u
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式__________________________
__________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
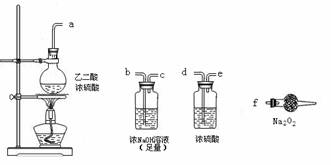
已知:H2C2O4 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;CO(g)+![]() O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源k.s.5.u
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式___________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;CO(g)+![]() O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源k.s.5.u
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式__________________________
__________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
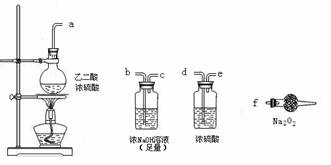
|
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5 kJ?mol -1 ;CO(g)+![]() O2(g)=CO2(g),△H=-283.0 kJ?mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0 kJ?mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com