
题目列表(包括答案和解析)
(10分) 自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构
和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为 。
(2)以苯乙炔(CH≡C- )为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
)为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
(3)已知上述系列第1至第4种物质分别溶解于有机溶剂中,可形成胶体,则分散质的分子直径大约在 之间,可通过 现象证明所形成的分散系为胶体。
(4)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(10分) 已知:⑴同一碳原子上连两个羟基的结构是不稳定的结构。A、B是分子式相同的且结构稳定的两种有机物。
⑵取0.1mol A完全燃烧,得二氧化碳26.4g。
⑶在浓硫酸存在的条件下,A、B分别跟足量的乙酸反应,分别生成C、D两种有机物。其中C的相对分子质量比A的相对分子质量大42。
(备注:乙酸的相对分子质量分别为60。)
⑷B、E以任意质量比混合,只要总质量不变,完全燃烧后耗氧气量和生成的水量都不变。
⑸0.1mol E能与足量银氨溶液反应生成43.2g银,且E的相对分子质量小于58。
⑹B能与新制氢氧化铜的悬浊液反应生成红色沉淀。
⑺A的任意一个羟基被溴原子取代所得的一溴代物都只有一种。
通过计算和推理,确定A、B、E各物质的结构简式分别为:
A B E
⑵写化学反应方程式(有机物写结构简式)。
B→D:
B与新制氢氧化铜:
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
(10分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
① Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 ;1 mol该晶体中含有 mol的化学键
(10分).698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)  2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。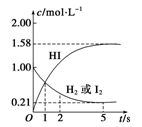
请回答下列问题:
(1)V=__________。
(2)该反应达到最大限度的时间是________,该时间内平均反应速率v(HI)=________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com