
题目列表(包括答案和解析)
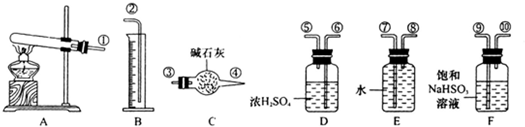
已知在pH=4-5的环境中,Cu2+几乎不水解,而Fe3+几乎水解完全。实验小组的同学欲通过电解CuSO4溶液,并根据电极上析出铜的质量及产生气体的体积粗略测定铜的相对原子质量。实验方案如下图流程所示:

试回答实验中的下列问题:
(1)步骤①中所加入A的化学式为_________,加入A的作用是_________________。
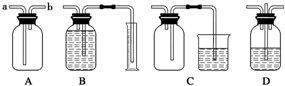
(2)步骤②所用部分仪器装置如右图所示。实验中,石墨电极上的电极反应式为____________________。电解反应总的离子方程式是______________________。
|
A.准确称量电解前铜电极的质量
B.电解后的电极在烘干称量前,须用蒸馏水冲洗
C.电极在烘干称量时的操作必须按烘干→称量→
再烘干→再称量,到连续两次称量的质量差不
超过0.1g为止
D.在有空气存在的情况下,电极烘干必须采用低
温烘干法
(4)根据实验获得的数据,铜的相对原子质量为_________
(用题中所给数据表示)。
已知在pH=4-5的环境中,Cu2+几乎不水解,而Fe3+几乎水解完全。实验小组的同学欲通过电解CuSO4溶液,并根据电极上析出铜的质量及产生气体的体积粗略测定铜的相对原子质量。实验方案如下图流程所示:

试回答实验中的下列问题:
(1)步骤①中所加入A的化学式为_________,加入A的作用是_________________。
(2)步骤②所用部分仪器装置如右图所示。实验中,石墨电极上的电极反应式为____________________。电解反应总的离子方程式是______________________。
|
A.准确称量电解前铜电极的质量
B.电解后的电极在烘干称量前,须用蒸馏水冲洗
C.电极在烘干称量时的操作必须按烘干→称量→
再烘干→再称量,到连续两次称量的质量差不
超过0.1g为止
D.在有空气存在的情况下,电极烘干必须采用低
温烘干法
(4)根据实验获得的数据,铜的相对原子质量为_________
(用题中所给数据表示)。
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
| △ |
| △ |
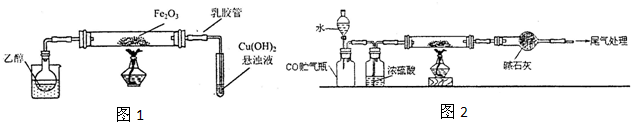
| x |
| y |
| 2(a-b) |
| 7b |
| 2(a-b) |
| 7b |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com