
题目列表(包括答案和解析)
| ||
| ||
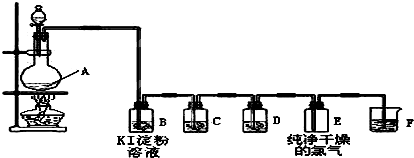
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混
有CO2、SO2等杂质。某课外小组设计了如图所示装置,证明乙烯中混有CO2、SO2并验
证乙烯的性质。
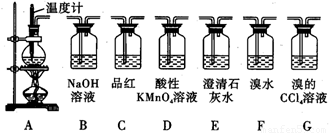
回答下列问题:
(1)烧瓶中素烧瓷片的作用是 。
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入 (填图中代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通过B装置再通入 装置,也可将混合气体干燥后直接通入 装置。
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水中无明显变化、D后面的石灰水变浑浊。请对出现该现象的原因进行合理猜想 。
(4)若要一次性将三种气体全部检验出来:
①检验的顺序是(填气体名称) ;
②上述装置组装的顺序中最简便的是:A→ ,证明C02存在的现象是 。


 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
A.20 mL 3 mol·L-1 X的溶液 B.20 mL 2 mol·L-1 X的溶液
C.10 mL 4 mol·L-1 X的溶液 D.10 mL 2 mol·L-1 X的溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com