
题目列表(包括答案和解析)
用98%的浓硫酸(密度为1.84gcm-3)配制1mol·L-1的稀硫酸100mL。配制过程中可能用到下列仪器,且其中按使用仪器的先后顺序排列正确的是( )
①100mL量简 ②10mL量筒 ③50mL烧杯
④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管
⑦玻璃棒
A.④③①⑤⑥ B.②⑤⑦⑥
C.①③⑤⑥⑦ D.②③⑦⑤⑥
①100mL量简 ②10mL量筒 ③50mL烧杯
④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管
⑦玻璃棒
A.④③①⑤⑥ B.②⑤⑦⑥
C.①③⑤⑥⑦ D.②③⑦⑤⑥
|
下列判断正确的是 | |
| [ ] | |
A. |
测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值 |
B. |
相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量 |
C. |
0.1 mol·L-1m的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH |
D. |
1 L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1 L mol·L-1硫化钠溶液吸收SO2的量 |
|
用NA表示阿伏加德罗常数,下列说法 ①18 g D2O含有的电子数为10 NA ②同温、同太下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4 L SO3的物质的量为1 mol ⑤4℃时5.4 mL的水所含的原子总数为0.9 NA ⑥0.1 mol OH-含NA个电子 ⑦1 mol Na2O2与水完全反应时转移电子数为2 NA 正确的组合为 | |
| [ ] | |
A. |
③⑤⑥⑦ |
B. |
③⑤⑥ |
C. |
①②④⑦ |
D. |
③④⑤⑥ |
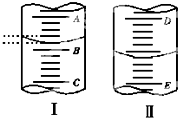 (1)图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是 mL.
(1)图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是 mL.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com