
题目列表(包括答案和解析)
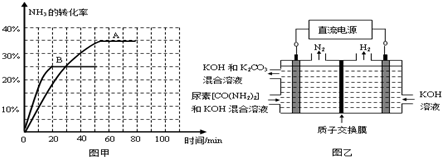
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色。如何正确识别这些物质的真伪,既检验同学们将化学知识应用于社会生活实际的能力,又可以减少伪劣物品对我们生活质量产生的负面影响。请选择下列鉴别试剂或鉴别方法:
| A.新制氢氧化铜 | B.碘水 | C.浓硝酸 | D.银氨溶液 E、燃烧 |

糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色。如何正确识别这些物质的真伪,既检验同学们将化学知识应用于社会生活实际的能力,又可以减少伪劣物品对我们生活质量产生的负面影响。请选择下列鉴别试剂或鉴别方法:
A、新制氢氧化铜 B、碘水 C、浓硝酸 D、银氨溶液 E、燃烧
以及实验现象:① 烧焦羽毛味; ② 蓝色;③ 银镜(析出银);④黄色;
⑤ 砖红色沉淀 用相应的序号填写下表:

下列四个坐标图:表示用氯化铝溶液滴定氢氧化钠溶液,正确的图是
[
](
图中纵坐标为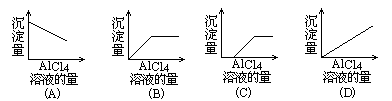
| |||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com