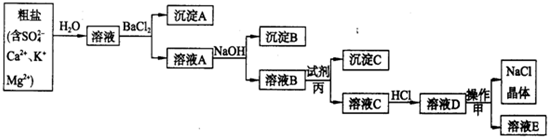
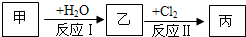
(2011?宜宾模拟)A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.

(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、D、F所含元素的原子序数之和为28,则F所含元素在周期表中的位置是
第二周期第ⅥA族
第二周期第ⅥA族
;反应①的化学方程式是:
.
(2)若A是生产和生活中使用最多的金属单质,D、F是气态单质,反应①、反应②都在水溶液中进行,则反应②的离子方程式是:
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;实验室D在F中安全的进行反应时,④的现象是
安静的燃烧,苍白色火焰,并有白雾
安静的燃烧,苍白色火焰,并有白雾
.
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②、③、④都需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是
;反应③的化学方程式是
.
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都会生成有颜色的气体,B的结构式是
O=C=O
O=C=O
;反应③的化学方程式是
Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
.