
题目列表(包括答案和解析)
(1)钠与水的反应实验过程:将钠用________从煤油中取出,用________吸干煤油,然后在________上将钠用________切下块(选填“大”或“小”),投入盛有50mL水的锥形瓶中,充分反应后,滴人3滴酚酞。
反应原理:________。

注意事项:取钠块不要太大,否则易发生爆炸。不要用东西盖住锥形瓶,也不要用火点燃锥形瓶中的气体。
实验现象;①________,
②________,
③________,
④________。

实验结论:金属钠跟水反应的条件是_________;反应剧烈程度________;生成物的碱性________。
(2)镁与水的反应实验过程:①②③④反应原理:________。
注意事项:要用砂布除尽镁条表面的氧化膜,此反应需要加热或用热水。
实验现象:________实验结论:金属镁跟水反应的条件是________。反应剧烈程度________,生成物的碱性________

(3)铝与水的反应实验过程:①②③④反应原理:________注意事项:要除尽铝片表面的氧化膜。若用氢氧化钠溶液除表面的氧化膜,除后必须用清水把表面溶液洗净。此反应需加热或用热水。
实验现象:________实验结论:金属铝跟水反应的条件是________,反应剧烈程度________,生成物的碱性________。
钠、镁、铝等金属单质与水反应的情况
(1)钠与水的反应实验过程:将钠用________从煤油中取出,用________吸干煤油,然后在________上将钠用________切下块(选填“大”或“小”),投入盛有50mL水的锥形瓶中,充分反应后,滴人3滴酚酞。
反应原理:________。

注意事项:取钠块不要太大,否则易发生爆炸。不要用东西盖住锥形瓶,也不要用火点燃锥形瓶中的气体。
实验现象;①________,
②________,
③________,
④________。

实验结论:金属钠跟水反应的条件是_________;反应剧烈程度________;生成物的碱性________。
(2)镁与水的反应实验过程:①②③④反应原理:________。
注意事项:要用砂布除尽镁条表面的氧化膜,此反应需要加热或用热水。
实验现象:________实验结论:金属镁跟水反应的条件是________。反应剧烈程度________,生成物的碱性________

(3)铝与水的反应实验过程:①②③④反应原理:________注意事项:要除尽铝片表面的氧化膜。若用氢氧化钠溶液除表面的氧化膜,除后必须用清水把表面溶液洗净。此反应需加热或用热水。
实验现象:________实验结论:金属铝跟水反应的条件是________,反应剧烈程度________,生成物的碱性________。

| V3-(V2-V1) |
| 22400m |
| V3-(V2-V1) |
| 22400m |
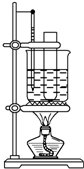 实验室制备硝基苯的方法是苯与浓硫酸和浓硝酸的混合液加热到55℃~60℃反应,已知苯与硝基苯的基本物理性质如下表所示:
实验室制备硝基苯的方法是苯与浓硫酸和浓硝酸的混合液加热到55℃~60℃反应,已知苯与硝基苯的基本物理性质如下表所示:| 熔点 | 沸点 | 状态 | |
| 苯 | 5.51℃ | 80.1℃ | 液体 |
| 硝基苯 | 5.7℃ | 210.9℃ | 液体 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com