
题目列表(包括答案和解析)
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C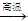 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=—889.6 kJ/mol
H2O(l)=H2O(g) △H3=+44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4mol A和2 mol B,发生如下反应:
2A(g) + B(g) C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 molB B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 molD D.2 molA、1mol B、1 mol C、1 mol D
(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C4FeO+CO2?。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g) ![]() C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D

| ||
| ||
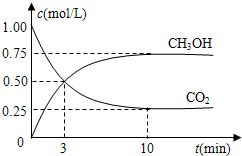
| n(CH3OH) |
| n(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com