
题目列表(包括答案和解析)
实验室用浓盐酸、MnO2共热制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。
现已知反应:2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
温度稍高即发生副反应:6Cl2+6Ca(OH)2==Ca(ClO3)2+5CaCl2+6H2O
现有三个同学分别设计的三套实验装置如下:

(1)请从①不容易控制反应速率,②容易控制反应速率,③有副反应发生,④可防止副反应发生,⑤污染环境,⑥可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 |
甲装置 |
|
|
乙装置 |
|
|
丙装置 |
|
|
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是________________________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量_______________0.15 mol(填“大于”“小于”或“等于”),其原因是____________(假定各步反应均无反应物损耗,且无副反应发生)。
测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4![]() +5HCHO+H+
+5HCHO+H+![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2![]() +5H
+5H![]() 2Mn2++10CO2 ↑+8H2O
2Mn2++10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)
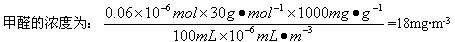
测定步骤:
①收集待检新装修的房屋居室空气
②准确量取5.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol·L-1的H2SO4溶液,加水45 mL稀释备用。
③将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
完成以下问题:
(1)使用________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
___________________________。
(3)本实验是否需要外加指示剂?若需要,请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
___________________________。
(4)计算该居室内空气中甲醛的浓度_________mg·m-3,该居室的甲醛_________(填“是”或“否”)超标。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL废液,向其中加入
(1)该厂生产的废液中所含金属离子有________________________。
(2)该厂原来使用的FeCl3溶液的物质的量浓度____________(反应前后溶液的体积变化忽略?不计)。
(3)若向500.00 mL废液中加入足量的稀硝酸,在标准状况下生成NO气体
(4)另取500.00 mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为________________________________________。
实验室用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:2Cl2+2Ca(OH)2====Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应:6Cl2+6Ca(OH)2![]()
Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如图所示:
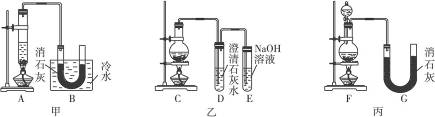
(1)a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境,请从这几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是__________________。
(3)实验室中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________0.15 mol(填“大于”“小于”或“等于”),其原因是(假定各步反应均无反应物损耗,且无副反应发生)________________________。
(10分)实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
|
| 优点 | 缺点 |
| 甲装置 |
|
|
| 乙装置 |
|
|
| 丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为 ;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因
。
(3)如果反应前加入了m g Ca(OH)2,反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简): 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com