
题目列表(包括答案和解析)
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
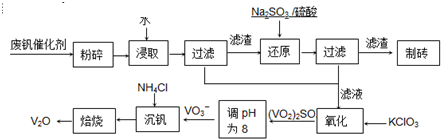
 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为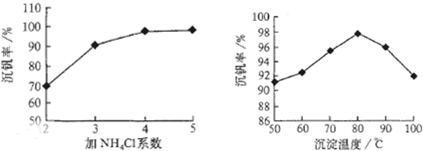
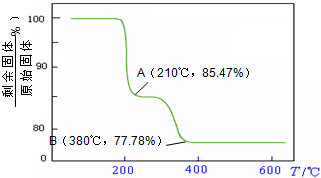 则NH4VO3在分解过程中
则NH4VO3在分解过程中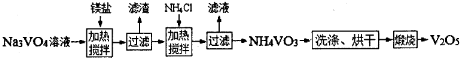
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为___________________________________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成![]() ,再用盐酸、硫酸亚铁、草酸等测定钒。总反应式可表示为
,再用盐酸、硫酸亚铁、草酸等测定钒。总反应式可表示为![]() +H2C2O4→VO++CO2+H2O(未配平),其中还原剂是___________。若消耗0.9 g草酸,所对应钒元素质量是_________g。
+H2C2O4→VO++CO2+H2O(未配平),其中还原剂是___________。若消耗0.9 g草酸,所对应钒元素质量是_________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com